Formic acid 98-100% MERCK
اسید فرمیک یا اسید متانوئیک سیستماتیک، ساده ترین اسید کربوکسیلیک است و دارای فرمول شیمیایی HCOOH است. این ماده یک واسطه مهم در سنتز شیمیایی است و به طور طبیعی تولید می شود. کلمه “formic” از کلمه لاتین ant formica گرفته شده است که به تقطیر بدن مورچه اشاره دارد. استر، نمک و آنیون اسید فرمیک فرمت نامیده می شود. در صنعت، اسید فرمیک از متانول تولید می شود.
تاریخچه اسید فرمیک
برخی از کیمیاگران و طبیعتشناسان میدانستند که مورچهها بخار اسیدی را در اوایل قرن پانزدهم منتشر میکنند. اولین کسی که جداسازی این ماده را (با تقطیر تعداد زیادی مورچه) توصیف کرد، جان ری طبیعت شناس انگلیسی در سال 1671 بود. مورچه ها اسید فرمیک را برای اهداف حمله و دفاع ترشح می کنند. اسید فرمیک اولین بار توسط شیمیدان فرانسوی Joseph Guy Lussac از اسید هیدروسیانیک ساخته شد. در سال 1855 شیمیدان فرانسوی دیگری به نام مارسلین برترلو با سنتز مونوکسید کربن اسید فرمیک تولید کرد. اسید فرمیک مدتهاست که به عنوان یک ترکیب شیمیایی مورد توجه کمی در صنایع شیمیایی در نظر گرفته شده است. در اواخر دهه 1960، مقادیر قابل توجهی به عنوان محصول جانبی تولید اسید استیک در دسترس قرار گرفت. اکنون این ماده به عنوان یک عامل نگهدارنده و ضد باکتری در خوراک دام افزایش یافته است.
اسید فرمیک به نام مورچه هایی که غلظت بالایی از ترکیب در سم خود دارند، نامگذاری شده است. در مورچه ها، اسید فرمیک از طریق ماده میانی از سرین گرفته می شود. پایه مزدوج اسید فرمیک، فرمات، نیز به طور گسترده در طبیعت وجود دارد. روش سنجش اسید فرمیک در مایعات بدن که برای تعیین فرمات پس از مسمومیت با متانول طراحی شده است، بر اساس واکنش فرمات با فرمید دهیدروژناز باکتری است.
اسید فرمیک در غلظت 98%-100% قابل اشتعال است. اسید فرمیک حاوی 53 گرم در لیتر هیدروژن در دمای اتاق و فشار اتمسفر است که سه و نیم برابر آن است که گاز هیدروژن فشرده می تواند در فشار 350 بار به دست آورد. اسید فرمیک خالص مایعی است که نقطه اشتعال آن 69 درجه سانتیگراد است، بسیار بالاتر از میزان بنزین (40- درجه سانتیگراد) یا اتانول (13 درجه سانتیگراد) می باشد.
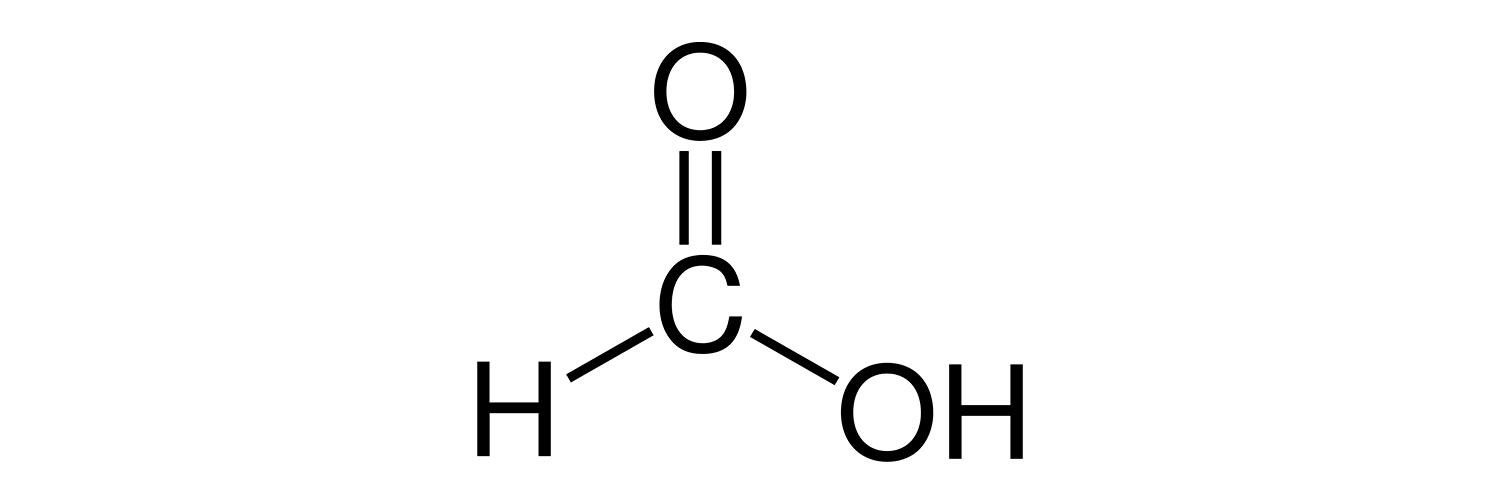
خواص اسید فرمیک مرک
اسید فرمیک مایعی بی رنگ با بوی تند است که با آب و اکثر حلال های آلی قطبی قابل اختلاط است و تا حدی در هیدروکربن ها محلول است. در هیدروکربن ها و در فاز بخار، بیشتر مولکول های منفرد از دیمرهای پیوند هیدروژنی تشکیل شده اند. اسید فرمیک گازی به دلیل تمایل به پیوند هیدروژنی از قانون گاز ایده آل تبعیت نمی کند. اسید فرمیک جامد، که می تواند در هر دو چند شکلی وجود داشته باشد، از یک شبکه موثر بی پایان از مولکول های اسید فرمیک با پیوند هیدروژنی تشکیل شده است. اسید فرمیک با آب یک آزئوتروپ کم جوش تشکیل می دهد. اسید فرمیک مایع تمایل به فوق سرد شدن دارد.
در سال 2009، ظرفیت تولید جهانی اسید فرمیک 720000 تن در سال بود که تقریباً به طور مساوی بین اروپا و آسیا تقسیم شد، در حالی که تولید در تمام قاره های دیگر کمتر از 1000 تن در سال بود. از نظر تجاری، در محلول هایی با غلظت های مختلف بین 85 تا 99 درصد وزنی وجود دارد.
اسید فرمیک در مقایسه با سایر اسیدهای کربوکسیلیک دارای بیشترین خواص شیمیایی است. محلول های موجود در الکل ها به دلیل اسیدیته بالا، خود به خود استرها را تشکیل می دهند. اسید فرمیک برخی از خواص احیایی محلول های آلدهید، طلا، نقره و پلاتین را در فلزات توزیع می کند.
تولید طبیعی اسید فرمیک
در طبیعت، اسید فرمیک در اکثر مورچه ها و در زنبورهای بدون نیش از جنس Oxytrigona یافت می شود. مورچه های چوبی می توانند اسید فرمیک را روی طعمه خود بپاشند یا از لانه خود دفاع کنند. کرم ابریشم نیز در صورت تهدید شکارچیان آن را سمپاشی می کند. همچنین در موهای گزنه یافت می شود. اسید فرمیک یک جزء طبیعی در اتمسفر است که به دلیل انتشارات جنگلی رخ می دهد.
تولید اسید فرمیک
تولید اسید فرمیک در ایران به روش های مختلفی انجام می شود. هنگامی که متانول و مونوکسید کربن در حضور یک باز قوی با هم ترکیب می شوند، متیل فرمت مطابق معادله شیمیایی تولید می شود:
تولید اسید فرمیک
در صنعت، این واکنش در فاز مایع با فشار بالا انجام می شود. شرایط معمول واکنش در دمای 80 درجه سانتی گراد و فشار 40 اتمسفر است. پرکاربردترین پایه متوکسید سدیم است. از هیدرولیز متیل فرمات، اسید فرمیک تولید می شود:
فروش اسید فرمیک
هیدرولیز موثر متیل فرمات به مقادیر زیادی آب نیاز دارد. از برخی جهات، متیل فورمات ابتدا با آمونیاک به فرمامید تبدیل می شود و سپس با اسید سولفوریک هیدرولیز می شود.
اسید فرمیک صنعتی
روش دیگر تولید اسید فرمیک با استخراج مایع-مایع با پایه آلی از آب است. مقدار قابل توجهی اسید فرمیک به عنوان یک محصول جانبی در ساخت سایر مواد شیمیایی تولید می شود.
تجزیه اسید فرمیک
گرما و به خصوص اسیدها باعث تجزیه اسید فرمیک به مونوکسید کربن (CO) و آب می شوند. در حضور پلاتین، اسید فرمیک با آزاد شدن هیدروژن و دی اکسید کربن تجزیه می شود.
کاربرد اسید فرمیک
کاربردهای اسید فرمیک بسیار گسترده است و شامل موارد زیر است:
به عنوان یک عامل نگهدارنده و ضد باکتری در خوراک دام
برای تقویت تخمیر اسید لاکتیک
سرکوب تشکیل اسید بوتیریک
کاهش از دست دادن ارزش غذایی در فرآیند تخمیر
برای حفظ خوراک زمستانی گاو
برای کشتن باکتری ها
در تولید چرم، از جمله دباغی
در رنگرزی و تکمیل منسوجات
به عنوان منعقد کننده در تولید لاستیک
به جای اسیدهای معدنی برای محصولات پاک کننده مختلف مانند پاک کننده آهک
در استرهای فرمت طعم دهنده ها
برای تولید عطرهای مصنوعی
در زنبورها، شما آن را به عنوان یک قاتل در برابر کنه ها دارید
در درمان بیماری زگیل
به عنوان پیل سوختی
به عنوان واسطه ای برای تولید ایزوبوتانول از CO2 با استفاده از میکروب ها
به عنوان فاز متحرک در کروماتوگرافی مایع با کارایی بالا HPLC
به عنوان یک اصلاح کننده PH فرار
در الکتروفورز مویرگی
منبعی برای گروه فرمیل
به عنوان منبع یون هیدرید
به عنوان منبع هیدروژن در انتقال هیدروژناسیون
تولید مونوکسید کربن
به عنوان وسیله ای برای ذخیره هیدروژن
به عنوان یک افزودنی غذایی
در سنتز مواد دارویی مانند انسولین و کافئین








Reviews
There are no reviews yet.